Bihar Board class 10 Science chapter 2 – “अम्ल, क्षारक एवं लवण” solutions are available here. This is our free guide that provides you all the questions and answers of chapter 2 in hindi medium.
Bihar Board class 10 Science chapter 2 में, हम रसायन विज्ञान के तीन महत्वपूर्ण वर्गों – अम्ल, क्षारक और लवण के बारे में विस्तार से जानेंगे। ये पदार्थ हमारे दैनिक जीवन में कई रूपों में मौजूद हैं, जैसे नींबू में अम्ल, साबुन में क्षारक और खाने के नमक में लवण। हम इन पदार्थों के गुणधर्मों, उनकी प्रकृति और उनके बीच होने वाली अभिक्रियाओं का अध्ययन करेंगे। इसके अलावा, हम pH मान की अवधारणा को समझेंगे, जो किसी पदार्थ की अम्लीय या क्षारीय प्रकृति को मापने का एक महत्वपूर्ण तरीका है। यह अध्याय हमें इन पदार्थों के व्यावहारिक अनुप्रयोगों और उनके पर्यावरणीय प्रभावों के बारे में भी जानकारी देगा।

Bihar Board Class 10 Science Chapter 2 Solutions
| Subject | Science |
| Class | 10th |
| Chapter | 2. अम्ल, क्षारक एवं लवण |
| Medium | Hindi (Bihar Board) |
अध्ययन के बीच वाले प्रश्न :-
अनुच्छेद 2.1 पर आधारित
प्रश्न 1. पीतल एवं ताँबे के बर्तनों में दही एवं खट्टे पदार्थ क्यों नहीं रखने चाहिए?
उत्तर: पीतल और ताँबे के बर्तनों में दही और खट्टे पदार्थ नहीं रखने चाहिए क्योंकि:
- दही और खट्टे पदार्थ अम्लीय होते हैं।
- ये अम्ल पीतल और ताँबे से अभिक्रिया करके हानिकारक धातु लवण बनाते हैं।
- इससे भोजन में जहरीले यौगिक मिल जाते हैं, जो स्वास्थ्य के लिए हानिकारक हो सकते हैं।
- इसके अलावा, इस अभिक्रिया से बर्तन भी खराब हो जाते हैं।
प्रश्न 2. धातु के साथ अम्ल की अभिक्रिया होने पर सामान्यतः कौन-सी गैस निकलती है? एक उदाहरण के द्वारा समझाइए। इस गैस की उपस्थिति की जाँच आप कैसे करेंगे?
उत्तर: धातु के साथ अम्ल की अभिक्रिया से सामान्यतः हाइड्रोजन (H₂) गैस निकलती है।
उदाहरण: जिंक और सल्फ्यूरिक अम्ल की अभिक्रिया
Zn (s) + H₂SO₄ (aq) → ZnSO₄ (aq) + H₂ (g)
हाइड्रोजन गैस की जाँच:
- एक जलती हुई मोमबत्ती या तीली को गैस के पास लाएं।
- हाइड्रोजन गैस “पॉप” की आवाज के साथ जलेगी।
- यह परीक्षण सावधानी से करना चाहिए क्योंकि हाइड्रोजन अत्यधिक ज्वलनशील है।
प्रश्न 3. कोई धातु यौगिक ‘A’ तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करता है तो बुदबुदाहट उत्पन्न होती है। इससे उत्पन्न गैस जलती मोमबत्ती को बुझा देती है। यदि उत्पन्न यौगिकों में से एक कैल्सियम क्लोराइड है, तो इस अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
उत्तर: दी गई जानकारी से, यौगिक ‘A’ कैल्सियम कार्बोनेट (CaCO₃) है।
अभिक्रिया का संतुलित समीकरण:
CaCO₃ (s) + 2HCl (aq) → CaCl₂ (aq) + H₂O (l) + CO₂ (g)
इस अभिक्रिया में:
- कैल्सियम कार्बोनेट, हाइड्रोक्लोरिक अम्ल से अभिक्रिया करता है।
- कैल्सियम क्लोराइड, पानी और कार्बन डाइऑक्साइड गैस बनती है।
- CO₂ गैस बुदबुदाहट पैदा करती है और जलती मोमबत्ती को बुझा देती है।
अनुच्छेद 2.2 पर आधारित
प्रश्न 1. HCl, HNO₃ आदि जलीय विलयन में अम्लीय अभिलक्षण क्यों प्रदर्शित करते हैं, जबकि ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों के विलयनों में अम्लीयता के अभिलक्षण नहीं प्रदर्शित होते हैं?
उत्तर:
- HCl, HNO₃ जैसे अम्ल जल में घुलकर H⁺ आयन देते हैं, जो अम्लीय गुण प्रदान करते हैं। उदाहरण: HCl + H₂O → H₃O⁺ + Cl⁻
- ऐल्कोहॉल और ग्लूकोज जैसे कार्बनिक यौगिक जल में H⁺ आयन नहीं देते।
- इनमें OH समूह होता है, लेकिन वे इसे आयनित नहीं करते, इसलिए अम्लीय व्यवहार नहीं दिखाते।
प्रश्न 2. अम्ल का जलीय विलयन क्यों विद्युत का चालन करता है?
उत्तर: अम्ल जलीय विलयन में हाइड्रोजन आयन (H⁺) देते हैं तथा विद्युत इन्हीं आयनों के द्वारा चालन करती है।
प्रश्न 3. शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को क्यों नहीं बदलती है?
उत्तर: शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को इसलिए नहीं बदलती; क्योंकि शुष्क HCl गैस में हाइड्रोजन आयन (H⁺) आयन नहीं होते इसलिए यह अम्लीयता का अभिलक्षण प्रदर्शित नहीं करती है।
प्रश्न 4. अम्ल को तनुकृत करते समय यह क्यों अनुशंसित करते हैं कि अम्ल को जल में मिलाना चाहिए, न कि जल को अम्ल में?
उत्तर: अम्ल एवं जल की क्रिया अत्यन्त ऊष्माक्षेपी अभिक्रिया है; अत: यह अनुशंसित किया जाता है कि अम्ल को जल में मिलाना चाहिए न कि जल को अम्ल में। जल को अम्ल में मिलाने पर अत्यधिक ऊष्मा उत्सर्जित होने के कारण विस्फोट भी हो सकता है।
प्रश्न 5. अम्ल के विलयन को तनुकृत करते समय हाइड्रोनियम आयन (H₃O⁺) की सांद्रता कैसे प्रभावित हो जाती है?
उत्तर: अम्ल के विलयन को तनुकृत करते समय हाइड्रोनियम आयन (H₃O⁺) की सांद्रता में प्रति इकाई आयतन में कमी हो जाती है।
प्रश्न 6. जब सोडियम हाइड्रॉक्साइड विलयन में आधिक्य क्षारक मिलाते हैं तो हाइड्रॉक्साइड आयन (OH⁻) की सांद्रता कैसे प्रभावित होती है?
उत्तर: जब सोडियम हाइड्रॉक्साइड विलयन में आधिक्य क्षारक मिलाते हैं तो हाइड्रॉक्साइड आयन (OH⁻) की सांद्रता बढ़ जाती है।
अनुच्छेद 2.3 पर आधारित
प्रश्न 1. आपके पास दो विलयन ‘A’ एवं ‘B’ हैं। विलयन ‘A’ के pH का मान 6 है एवं विलयन ‘B’ के pH का मान 8 है। किस विलयन में हाइड्रोजन आयन की सांद्रता अधिक है? इनमें से कौन अम्लीय है तथा कौन क्षारकीय?
उत्तर: विलयन A (pH 6) अधिक अम्लीय है और इसमें H+ आयनों की सांद्रता अधिक है। विलयन B (pH 8) क्षारीय है।
प्रश्न 2. H+ (aq)आयन की सांद्रता का विलयन की प्रकृति पर क्या प्रभाव पड़ता है?
उत्तर: H+ आयनों की सांद्रता बढ़ने से विलयन अधिक अम्लीय होता है, और घटने से अधिक क्षारीय।
प्रश्न 3. क्या क्षारकीय विलयन में H+(aq) आयन होते हैं? अगर हाँ, तो यह क्षारकीय क्यों होते हैं?
उत्तर: क्षारीय विलयनों में भी H+ आयन होते हैं, लेकिन बहुत कम मात्रा में। इसलिए वे क्षारीय होते हैं।
प्रश्न 4. कोई किसान खेत की मृदा की किस परिस्थिति में बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) का उपयोग करेगा?
उत्तर: अम्लीय मिट्टी (pH < 7) को उदासीन करने के लिए किसान चूने या चॉक का उपयोग करते हैं।
अनुच्छेद 2.4 पर आधारित
प्रश्न 1. CaOCl2 यौगिक का प्रचलित नाम क्या है?
उत्तर: CaOCl2 यौगिक का प्रचलित नाम ब्लीचिंग पाउडर (विरंजक चूर्ण) है।
प्रश्न 2. उस पदार्थ का नाम बताइए जो क्लोरीन से क्रिया करके विरंजक चूर्ण बनाता है।
उत्तर: बुझा हुआ चूना [Ca(OH)2] क्लोरीन से क्रिया करके विरंजक चूर्ण बनाता है।
प्रश्न 3. कठोर जल को मृदु करने के लिए किस सोडियम यौगिक का उपयोग किया जाता है।
उत्तर: कठोर जल को मृदु करने के लिए सोडियम कार्बोनेट (NaCO3) का उपयोग किया जाता है।
प्रश्न 4. सोडियम हाइड्रोजनकार्बोनेट के विलयन को गर्म करने पर क्या होगा? इस अभिक्रिया के लिए समीकरण लिखिए।
उत्तर: सोडियम हाइड्रोजनकार्बोनेट की गर्म करने पर अभिक्रिया: 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
प्रश्न 5. प्लास्टर ऑफ पेरिस की जल के साथ अभिक्रिया के लिए समीकरण लिखिए।
उत्तर: प्लास्टर ऑफ पेरिस (CaSO₄·½H₂O) की जल के साथ अभिक्रिया: CaSO₄·½H₂O + 1½H₂O → CaSO₄·2H₂O
अभ्यास
प्रश्न 1. कोई विलयन लाल लिटमस को नीला कर देता है, इसका pH संभवतः क्या होगा?
(a) 1
(b) 4
(c) 5
(d) 10
उत्तर: (d) 10
प्रश्न 2. कोई विलयन अंडे के पिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न करता है जो चूने के पानी को दूधिया कर देती है। इस विलयन में क्या होगा?
(a) NaCl
(b) HCl
(c) LiCl
(d) KCl
उत्तर: (b) HCl
प्रश्न 3. NaOH का 10mL विलयन,HCl के 8mLविलयन से पूर्णतः उदासीन हो जाता है। यदि हम NaOH के उसी विलयन का 20 mLलें तो इसे उदासीन करने के लिए HCI के उसी विलयन की कितनी मात्रा की आवश्यकता होगी?
(a) 4 mL
(b) 8 mL
(c) 12 mL
(d) 16 mL
उत्तर: (d) 16 mL
प्रश्न 4. अपच का उपचार करने के लिए निम्न में से किस औषधि का उपयोग होता है?
(a) एंटीबायोटिक (प्रतिजैविक)
(b) ऐनालजेसिक (पीड़ाहारी)
(c) ऐन्टैसिड
(d) एंटीसेप्टिक (प्रतिरोधी)
उत्तर: (c) ऐन्टैसिड
प्रश्न 5. निम्न अभिक्रिया के लिए पहले शब्द-समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिए l
(a) तनु सल्फ्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है।
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम पट्टी के साथ अभिक्रिया करता है।
(c) तनु सल्फ्यूरिक अम्ल ऐलुमिनियम चूर्ण के साथ अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लौह के रेतन के साथ अभिक्रिया करता है।
उत्तर:
(a) जिंक + सल्फ्यूरिक अम्ल (तनु) → जिंक सल्फेट + हाइड्रोजन गैस
Zn + dil.H2SO4 → ZnSO4 + H2(g)
(b) मैग्नीशियम + हाइड्रोक्लोरिक अम्ल (तनु) → मैग्नीशियम क्लोराइड + हाइड्रोजन गैस
Mg + dil.2HCl → MgCl2 + H2(g)
(c) ऐलुमिनियम + सल्फ्यूरिक अम्ल (तनु) → ऐलुमिनियम सल्फेट + हाइड्रोजन गैस
2Al+ dil.3H2SO4 → Al2(SO4)3 + 3H2(g)
(d) आयरन + हाइड्रोक्लोरिक अम्ल (तनु) → आयरन क्लोराइड + हाइड्रोजन गैस
2Fe + dil.6HCl → 2FeCl3 + 3H2(g)
प्रश्न 6. ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होते हैं लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे साबित कीजिए।
उत्तर: एल्कोहॉल और ग्लूकोज में हाइड्रोजन होने के बावजूद वे अम्ल नहीं हैं। इसे समझने के लिए हम एक सरल प्रयोग कर सकते हैं:
- एक बीकर में एल्कोहॉल या ग्लूकोज का घोल लें।
- इसमें दो इलेक्ट्रोड डालें जो एक बैटरी और बल्ब से जुड़े हों।
- आप देखेंगे कि बल्ब नहीं जलता।
प्रेक्षण:
हम देखते हैं कि बल्ब नहीं जलता। अत: ग्लूकोज रबड़ कॉर्क और एल्कोहॉल विलयनों में विद्युत चालन नहीं होता।
परन्तु:
हम जानते हैं कि अम्लों में विद्युत चालन सम्भव है। परिणाम एल्कोहॉल और ग्लूकोज को अम्लों में वर्गीकृत नहीं किया जा सकता।
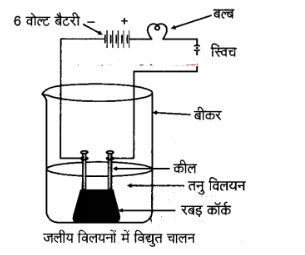
इसका कारण यह है कि एल्कोहॉल और ग्लूकोज में स्वतंत्र आयन नहीं होते, जबकि अम्लों में H+ आयन होते हैं जो बिजली का संचालन करते हैं। इसलिए ये पदार्थ अम्ल नहीं हैं।
प्रश्न 7. आसवित जल विद्युत का चालक क्यों नहीं होता जबकि वर्षा जल होता है?
उत्तर: आसवित जल शुद्ध H₂O होता है जिसमें कोई अन्य पदार्थ नहीं होता। इसलिए इसमें मुक्त आयन नहीं होते जो बिजली का संचालन कर सकें। वर्षा जल में वायुमंडल से घुले हुए गैसें और अन्य पदार्थ होते हैं, जैसे कार्बन डाइऑक्साइड, जो पानी के साथ मिलकर कार्बोनिक अम्ल बनाता है। यह अम्ल आयनों में टूट जाता है, जो बिजली का संचालन करते हैं।
प्रश्न 8. जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है?
उत्तर: अम्ल की अम्लीय प्रकृति H+ आयनों के कारण होती है। जब अम्ल पानी में घुलता है, तो वह H+ आयन देता है। बिना पानी के, अम्ल अपने मूल रूप में रहता है और H+ आयन नहीं बनाता। इसलिए, सूखे अम्ल में अम्लीय गुण नहीं दिखाई देते।
प्रश्न 9. पाँच विलयनों A,B,C,D व E की जब सार्वत्रिक सूचक से जाँच की जाती है तो pH के मान क्रमशः 4,1,11,7 एवं 9 प्राप्त होते हैं। कौन-सा विलयन
(a) उदासीन है?
(b) प्रबल क्षारीय है?
(c) प्रबल अम्लीय है?
(d) दुर्बल अम्लीय है?
(e) दुर्बल क्षारीय है?
pH के मानों को हाइड्रोजन आयन की सांद्रता के आरोही क्रम में व्यवस्थित कीजिए।
उत्तर: pH मान 0 से 14 तक होता है। 7 उदासीन, 7 से कम अम्लीय, और 7 से अधिक क्षारीय होता है।
(a) विलयन D उदासीन है (pH = 7)
(b) विलयन C प्रबल क्षारीय है (pH = 11)
(c) विलयन B प्रबल अम्लीय है (pH = 1)
(d) विलयन A दुर्बल अम्लीय है (pH = 4)
(e) विलयन E दुर्बल क्षारीय है (pH = 9)
H+ आयन की सांद्रता का आरोही क्रम: C < E < D < A < B
प्रश्न 10. परखनली ‘A’ एवं ‘B’ में समान लंबाई की मैग्नीशियम की पट्टी लीजिए। परखनली ‘A’ में हाइड्रोक्लोरिक अम्ल ( HCl) तथा परखनली ‘B’ में ऐसिटिक अम्ल (CH3COOH) डालिए। दोनों अम्लों की मात्रा तथा सांद्रता समान हैं। किस परखनली में अधिक तेजी से बुदबुदाहट होगी तथा क्यों?
उत्तर: उत्तर: परखनली A में HCl है जो एक प्रबल अम्ल है। यह पानी में पूरी तरह से आयनित हो जाता है और अधिक H+ आयन देता है। परखनली B में CH₃COOH है जो एक दुर्बल अम्ल है और कम आयनित होता है। इसलिए HCl मैग्नीशियम से तेजी से प्रतिक्रिया करेगा और परखनली A में अधिक बुदबुदाहट होगी।
प्रश्न 11. ताजे दूध के pH का मान 6 होता है। दही बन जाने पर इसके pH के मान में क्या परिवर्तन होगा? अपना उत्तर समझाइए।
उत्तर: जब दूध दही में बदलता है, तो उसमें मौजूद बैक्टीरिया दूध के शर्करा (लैक्टोज) को लैक्टिक अम्ल में बदल देते हैं। इस प्रक्रिया को किण्वन कहते हैं। लैक्टिक अम्ल बनने से दही का pH कम हो जाता है (लगभग 4.5), जिससे यह खट्टा हो जाता है। इसलिए दही का pH ताजे दूध से कम होता है।
प्रश्न 12. एक ग्वाला ताजे दूध में थोड़ा बेकिंग सोडा सोडा मिलाता है।
(a) ताजा दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय क्यों बना देता है ?
(b) इस दूध को दही बनने में अधिक समय क्यों लगता है ?
उत्तर: (a) ग्वाला दूध में बेकिंग सोडा मिलाकर इसके pH को बढ़ाता है क्योंकि:
- बेकिंग सोडा एक क्षारीय पदार्थ है जो दूध को थोड़ा क्षारीय बना देता है।
- क्षारीय माध्यम में बैक्टीरिया की वृद्धि धीमी होती है, जिससे दूध जल्दी खराब नहीं होता।
- यह दूध को अधिक समय तक ताजा रखने में मदद करता है।
(b) इस दूध को दही बनने में अधिक समय लगता है क्योंकि:
- दही बनने के लिए दूध का अम्लीय होना आवश्यक है।
- बेकिंग सोडा दूध को क्षारीय बना देता है।
- बैक्टीरिया को पहले इस क्षारीयता को खत्म करना पड़ता है, फिर दूध को अम्लीय बनाना पड़ता है।
- यह प्रक्रिया अधिक समय लेती है।
प्रश्न 13. प्लास्टर ऑफ पेरिस को आर्द्र-रोधी बर्तन में क्यों रखा जाना चाहिए? इसकी व्याख्या कीजिए।
उत्तर: प्लास्टर ऑफ पेरिस (CaSO₄·½H₂O) को आर्द्र-रोधी बर्तन में रखा जाता है क्योंकि:
- यह नमी के संपर्क में आकर जिप्सम (CaSO₄·2H₂O) में बदल जाता है।
- यह प्रतिक्रिया है: CaSO₄·½H₂O + 1½H₂O → CaSO₄·2H₂O
- जिप्सम बनने के बाद प्लास्टर ऑफ पेरिस अपने मूल गुण खो देता है।
- इसलिए इसे सूखा रखना जरूरी है ताकि यह अपने उपयोगी रूप में बना रहे।
प्रश्न 14. उदासीनीकरण अभिक्रिया क्या है? दो उदाहरण दीजिए।
उत्तर: उदासीनीकरण अभिक्रिया वह प्रक्रिया है जिसमें एक अम्ल और एक क्षार आपस में क्रिया करके लवण और पानी बनाते हैं। इस प्रक्रिया में अम्ल और क्षार के प्रभाव को नष्ट कर दिया जाता है।
उदाहरण:
HCl (अम्ल) + NaOH (क्षार) → NaCl (लवण) + H₂O (पानी)
H₂SO₄ (अम्ल) + 2KOH (क्षार) → K₂SO₄ (लवण) + 2H₂O (पानी)
प्रश्न 15. धोने का सोडा एवं बेकिंग सोडा के दो-दो प्रमुख उपयोग बताइए।
उत्तर:
- धोने का सोडा (Na₂CO₃) के उपयोग:
कपड़े धोने में – यह पानी को मृदु बनाता है और साबुन की कार्यक्षमता बढ़ाता है।
काँच उद्योग में – काँच बनाने के लिए कच्चे माल के रूप में।
- बेकिंग सोडा (NaHCO₃) के उपयोग:
बेकरी उत्पादों में – यह गर्म होने पर CO₂ गैस छोड़ता है जो केक और बिस्कुट को फुलाता है।
अम्लीयता कम करने में – पेट में अम्लता कम करने के लिए दवा के रूप में।
